| Speedy PCI |
Speedy PCI for ACS patient |
ACSのIVUS所見 |
Synergyステント 留置後の血管修復 |
STEMI病変の 早期及び慢性期healing |
| 伊苅 裕二 先生 (東海大学) |
早川 直樹 先生 (国保旭中央病院) |
園田 信成 先生 (佐賀大学) |
佐久間 理吏 先生 (獨協医科大学) |
森野 禎浩 先生 (岩手医科大学) |
Speedy PCI

伊苅裕二 先生(東海大学)
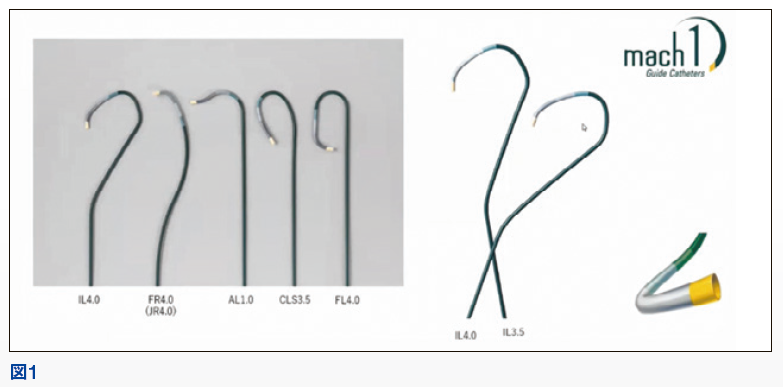
総虚血時間の短縮が近年重要視されている。総虚血時間の短縮を阻害する要因を分解すると、患者の遅延、搬送の遅延、Door to Balloon(ドアからカテ室までの遅延、カテ室からバルーンまでの遅延)が考えられるが、PCIの術者にとってはカテ室からバルーンまでを短縮することで貢献ができる。そのひとつの解決方法として、選択するカテーテルがあげられる。私が監修したカテーテルで最近発売されたものは、ボストンサイエンティフィック社からMach1のILがあげられる(図1)。Mach1のシャフトはトルク性がよく、軽やかに動く。鎖骨下動脈が蛇行していても追随性がよい。逆にトルクがたまっていると動きすぎるため、トルクを外す作業が必要になるくらいであり、カテ室からバルーンまでの短縮を目指して早く手技を進められる。実際台湾からの連続621例ILの使用報告では、左冠動脈のエンゲージ成功率は99%と非常に高く、左冠動脈損傷率は0%であり、左主幹部への高度の安全性が示されている(Ali A. Youssef et al. EuroInterv, 3:475-481,2007)。
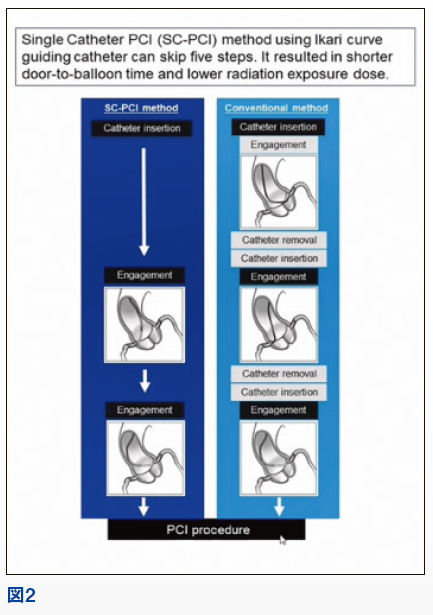
さらに、使用するカテーテルの本数も重要であり、造影カテーテルを使用せずILを1本しか使わないという方法がある(図2)。そこで、多施設共同研究にて造影カテーテルを使用した場合(Conventional群、977例)と使用せずIL1本のみを使用した場合(SC-PCI群、298例)で比較をしたところ、Door to Balloonにかかった所要時間において、有意にSC-PCI群で短かった(68±46分 vs 76±51分、p=0.02)。中でもシースからバルーンまでの時間で有意に短縮が見られ(P<0.0001)、透視時間と透視線量も有意に低下がみられた(LeeKH et al. Catheter Cardiovasc Interv. doi:10.1002/ccd.29797,2021 May 31.)
Speedy PCI for ACS patient

早川直樹 先生(国保旭中央病院)
当院では、年間800例弱のPCIを行っており、近年この件数は変わらない。しかし、地域の状況もありACSが増えている。ACSにおけるPCIの特徴として以下があげられるため、院内の整備、院外の協力、手技の精錬が必要である。
- スタッフが不十分であることが多い
- なにより早い再灌流が必要
- 患者背景・病変不明瞭
- 血栓性病変をどう処理するか
- 複雑病変が潜んでいる
そこで、当院でのDoor to Balloontimeを短縮する工夫をご紹介する。これらの取り組みを行っても急性心筋梗塞症例の平均で78分を要しており、まだ改善したいと考えている。
- 緊急当番体制(24時間、365日):1stを1-4年目で2人、2ndを5-10年目で1人、3rdを当日の責任者1人
- ERでのACSパス作成
- 初療医への教育、周辺施設への講演など
- PCI術者:2nd Drがメインで行い、複雑症例は3rd Drが行う
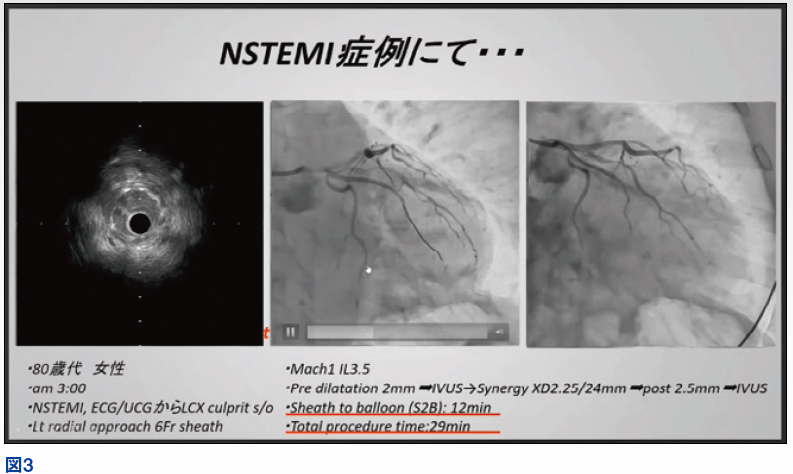
【症例】Door to Balloonを短縮するための症例として、手技時間の短縮にも努めており、Mach1 IL3.5を用いてシースからバルーンまで12分、トータル手技時間29分と迅速に行うことができた症例を紹介する。
80 歳代女性、ACS、NSTEMI、LCXculprit、左橈骨動脈アプローチ(6Fr)で行った(図3)。
また、血栓性病変に関する当院の取り組みを紹介する。フィルターデバイス、吸引カテーテルなど複数の方法が開発されており、有効性は報告されているがどうしても手技が煩雑になる。そのため、ACS病変に対してPerfusion balloonを用いて3分のLong Inflationを行い直接再灌流を得て(pre-dilatationを兼ねる)、IVUSをみながらステントを留置している。この方法を用いることで手技時間がAspiration群と比較して有意に短縮できている。
結論として、Speedy PCI実現のために以下を取り組んでいきたい。
- ILを用いたSingle catheterでのPCIによるSpeedy PCIの実現
- Perfusion balloon を用いたACS-PCIによる臨床成績向上や手技時間短縮
ACSのIVUS所見-これからのIVUS活用術-

園田信成 先生(佐賀大学)
ACSは早期の再灌流が必要であり、IVUSなどのイメージングを駆使して合併症をコントロールしながら欲張らないPCIを行うことが大切である。しかし、ガイドラインにはACSに対してイメージングの推奨は現時点では記載がない。その背景にはコストの問題があることも考えられる。日本はIVUSを使う環境が整っているため、有効に使っていきたい。IVUSの優位性があげられるのは、造影上hazinessがみられる特に以下のような場合である。
- 解離、フラップ、血腫
- 血栓
- 石灰化プラーク
- プラーク破裂やプラーク突出
- 血管リモデリング
そしてIVUSを駆使することで、以下のことが可能となる。
- 生体内で比較的病理像に近い像が得られる
- CAGではわからないプラークの性質の把握
- 病変に合わせたデバイス選択
- 正確な計測に基づくデバイスサイズの決定
- 治療のエンドポイントの決定
インターベンション治療における手技標準化ACSのIVUS読影ポイントは血栓像、プラーク破裂像、超音波減衰プラーク、滞留血流(Stagnated flow)があげられる。血栓像、プラーク破裂像、超音波減衰プラークに関して詳しく見ていく。
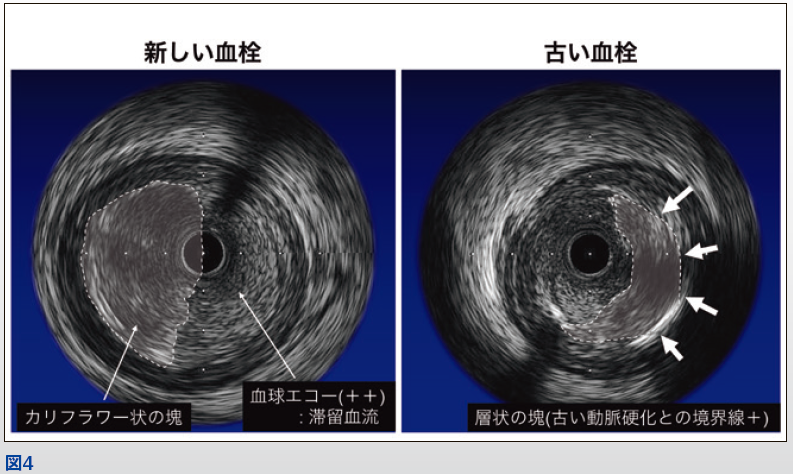
【血栓像】ACSのIVUS像で血栓を見る場合は血栓の年齢を考える必要がある。最も新しい血栓の場合は輝度が高く、その後落ちてまた輝度(器質化血栓)が高くなる。血管内腔にカリフラワー様に突出したMassは新しい血栓であり、内部に血球エコーや内腔に滞留血流が確認される。古い血栓の場合は内腔に凸状で層状に見える(図4)。IVUSで血栓を見分けるポイントとしては、以下があげられる。
- 可動性の塊(Massive thrombus)
- 形(カリフラワー、凸型、島状)
- 色調( 低輝度、speckling、scintillation)血球エコー(blood noise)、microchannel
- 動脈硬化との境界線(層状)プラーク破裂像
生食をフラッシュすればよく観察できる。最近はHD-IVUSが主流となり、比較 的OCTに近い像がみえる。Proximalのプラーク破裂は袋状になりTIMIが0になることが多く治療に苦慮するので、IVUSで破裂部位をよくみることで治療戦略の道筋になる。
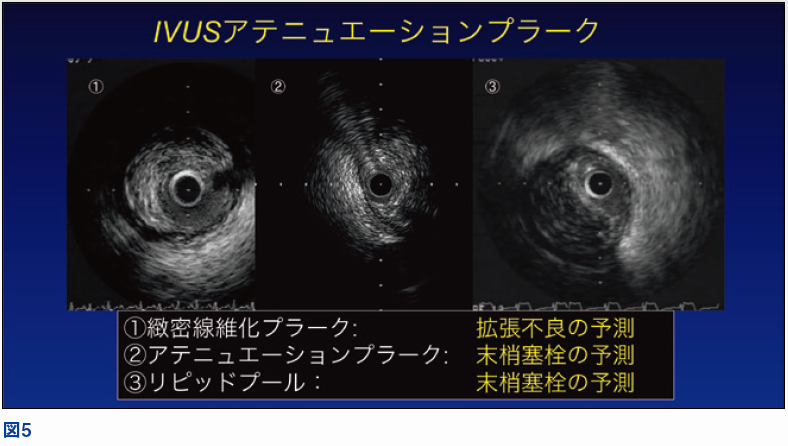
- 超音波減衰プラーク(attenuated plaque)
IVUSを用いて超音波減衰プラークをしっかり読み取ることは大切で(図5)、それにより末梢塞栓を予測しなければいけない。IVUS像をみても線維性皮膜の厚みはわからないが、プラークの角度がわかる。角度と脂質コアのサイズは比例するため、そこから予測が可能となる。180°以上5mmという数字を使ってカットオフをつくりPCIをするか末梢保護をするかを判断していくことは重要である。
特に超音波減衰プラークの長さが9mmを超える場合には重篤な合併症を予測し、何らかの処置を考えなければいけない。
急性冠症候群責任病変におけるSynergyステント留置後の血管修復

佐久間 理吏 先生(獨協医科大学)
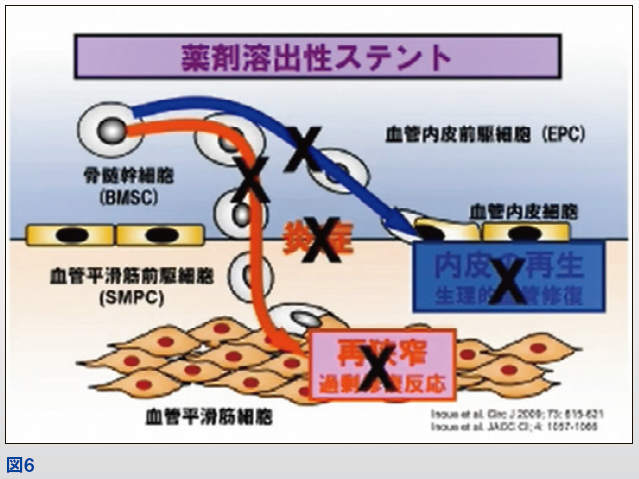
ステント留置後の血管傷害により炎症が生じ、骨髄由来幹細胞が血管内皮前駆細胞へ分化誘導され内皮の再生を促す。過度な炎症は血管平滑筋細胞の過剰増殖を引き起こし、ステント再狭窄をもたらす。薬剤溶出性ステントは、ステント留置後の炎症を抑えることで、血管平滑筋細胞増殖を抑制し再狭窄を減少させた。一方で血管内皮前駆細胞も抑えてしまうと、生理的血管修復が遅延する(図6)。
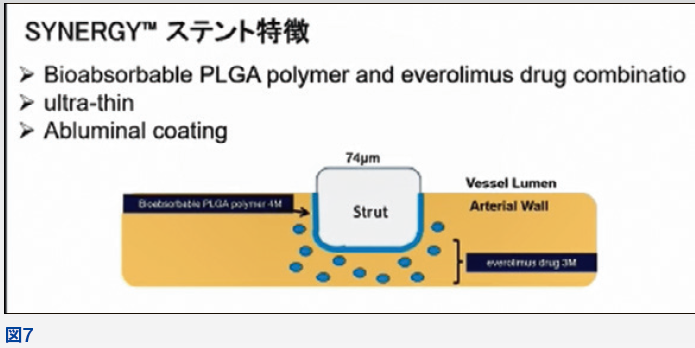
以前の我々の検討では第一世代、第二世代薬剤溶出性ステント留置後のCD34陽性細胞の動員は乏しく、生理的血管修復に遅延が生じていることを報告した。現在optimize healingを目的とした第三世代薬剤溶出性ステントが登場している。第三世代であるSYNERGYステントの構造をみてみると、薄いステントストラットと、血管に圧着する側にのみコーティングがされているAbluminal coating、そして3か月でエベロリムス、4か月でポリマーが消失するように設計されている(図7)。
我々はSYNERGYステントの特徴に注目し、ACS治療後の血管修復過程を、第二世代のPROMUS群と比較検討したので結果を紹介する。本研究は前向き非ランダム化比較試験を行い、PROMUS群19例、SYNERGY群52例を登録した。治療に関して、ステント本数がSYNERGY群で有意に多く使用していたが(1.12±0.33 vs 1.00±0.00、p=0.013)、両群のTIMI Grade3の割合に有意差はなかった。OCTによる観察では、3カ月後のステント被覆率はSYNERGY群で82.8±12.3 %、PROMUS群で85.9±12.3 % と有意差はなかったが、12か月後では98.0 ± 3.8 %、92.5 ± 9.8 % と有意にSYNERGY群でしっかりと被覆されていた(p=0.027)。血管内視鏡による評価では3か月後の時点でステント新生内膜被覆グレード0(no coverage) が、SYNERGY群24%に対し、PROMUS群70%と有意に多く、その結果壁在血栓も有意に多かった。全症例においてステント留置後第7日病日のCD34+/KDR+内皮前駆細胞の変化は、12か月後時点でのOCTで観察した新生内膜形成と有意な正の相関を示した。STEMI症例はNSTEMI/UA症例よりもCD34+細胞増加を認めており、SYNERGYステントのより早期の内膜修復が期待される。結論として、SYNERGYステントはPROMUSステントと比較して、ACS症例においてステント留置後の良好な血管修復が観察された(Sakuma M et al. Sci Rep. 11(1):17315,2021 Aug 27)
STEMI病変の早期及び慢性期healing-ステント間の相違について-

森野禎浩 先生(岩手医科大学)
薬剤溶出型ステント(DES)が全部同じという発想はあまりに乱暴であり、STEMI患者のステント選択について以下を考えることが大事である。
- 術中・直後のパフォーマンス:ステントのデザイン、デリバリ性能、末梢塞栓リスク、ステント圧着
- 留置後:血栓症の多い時期(早期)のパフォーマンス:抗血栓性能
- 留置後:再狭窄の多い時期(数か月から1年)のパフォーマンス:新生内膜抑制力、抗血栓性
- 留置後:neoatheroscrelosisが出てくる時期の長期的なパフォーマンス:ヒーリング性能
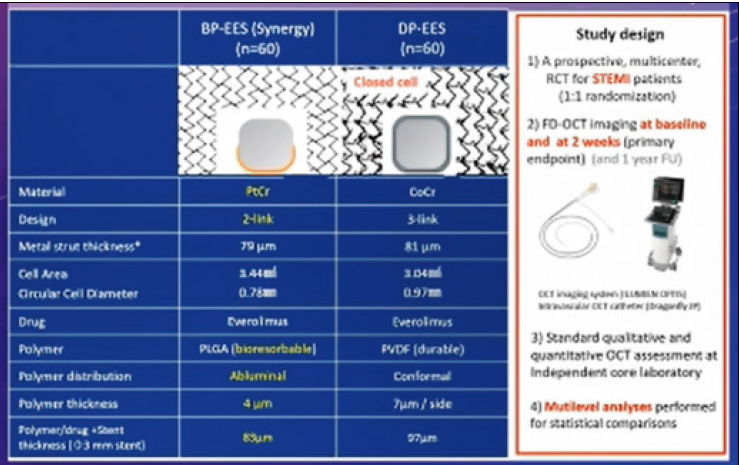
EXAMINATION試験で同じデザインのベアメタルとDESで5年間追跡した結果、血栓症は最初の2週間に差があった。最初の2週間に血栓症が起きるメカニズムがあると考えられ、2週間時点のOCTをずっと研究してきた。OCT/OFDIを用いたヒーリングに関する検討方法としては、厚さの定量、ストラットのカバーリング、血栓、突出、そしてPLIAスコアに代表される内膜の性質の評価などがあげられ、これらを駆使して比較研究を行ってきた。それがMECHANISM試験であり、一番新しいものとしてSYNERGYとDP-EESをSTEMIに留置し、経時的な変化をみて血管の反応の違いがステントごとにあるのかを調べてきた。一部公開できる範囲で結果を紹介する。
SYNERGYとDP-EESはどちらもエベロリムス溶出ステントであるが、構造は異なる(図8)。それぞれ60例ずつのRCT試験で比較を行ったところ、留置時の時点でのOCTの評価で有意差があり、SYNERGY群でMean malapposed areaが有意に小さかった。一方でステント内の組織量はSYNERGYで有意に多かったが、2週間後の組織量をみてみると留置時の血栓量は差がなくなっていた。2週後のストラットのカバー率は有意差なく、Mean malapposed areaはSYNERGYの方が小さい傾向にあったが2週間では大きくは差がなかった。では12か月後はどうか。公開できる範囲として、内視鏡を用いたサブ解析の結果では、1か月後で差がなかったステントストラットカバー率が1年後にはSYNERGYで有意に高くなっていた(p=0.001)。
以上の結果より、STEMI病変へのDES留置は、DESの種類によって血管反応が異なることはお伝えできる。そのため、DESのパフォーマンスの違いを知り、何を優先するか一例ずつ考えていただきたい。
- 留置時のMean malapposed area は2linkステントで小さい
- 急性期の抗血栓性は同等
- 慢性期の新生内膜抑制力は第2世代DESでより強力
- 慢性期のOCT所見によるストラット非被覆率は第3世代DESで低い( 特にSTEMI病変で差が大きい)
承認番号・販売名
販売名:シナジー ステントシステム
販売名:マック ワン コロナリーガイディングカテーテル