2019-1-25
本邦初のポリマーを搭載した末梢血管用薬剤溶出型「ELUVIA™ステント」新発売
~再狭窄を防ぐ薬剤放出調整能力と耐久性の向上により患者さんのQOL向上に貢献~
ボストン・サイエンティフィック ジャパン株式会社(本社:東京都中野区、代表取締役社長:内木祐介)は、末梢動脈疾患(PAD)に対する薬剤溶出型ステントで本邦初となる、生体適合性材料のフルオロポリマーを搭載した自己拡張型ナイチノールステント「ELUVIA™ステント」を発売いたしました。
末梢動脈疾患(PAD)の治療法の一つである血管内治療では、術後再狭窄が課題とされていました。ELUVIA™ステントは、生体適合性材料のフルオロポリマー(冠動脈ステントとして全世界で1000万例以上留置されている)の搭載により、薬剤(パクリタキセル)の持続的な放出と、耐久性の向上を実現することで、ステント留置後の再狭窄を予防し、再治療のリスクを低減させます。
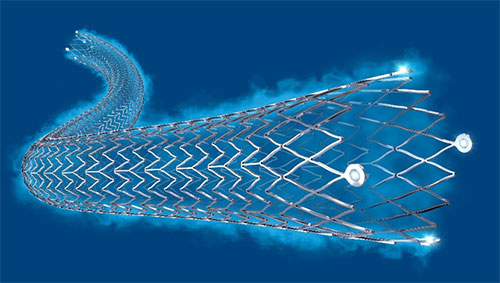
販売名:エルビア薬剤溶出型末梢血管用ステント(医療機器承認番号:23000BZX00374000)
■臨床試験結果について
84名の日本人を含む465名の患者さんを対象に、浅大腿動脈(superficial femoral artery :SFA)を対象にした初の薬剤溶出型ステント直接比較試験であるIMPERIAL試験では、有効性と安全性の主要評価項目が証明されました。本試験において、ELUVIA™ステント治療群の患者さんにおける12ヵ月後の一次開存率がカプランマイヤー推定値で88.5%と、他の薬剤溶出型ステント治療群の患者さんの79.5%と比較すると有意な結果となりました(p=0.0119)。さらに、他の薬剤溶出型ステント治療群の患者さんで観察された12ヵ月時点の標的病変の血行再建実施率9.0%と比較すると、ELUVIA™ステント治療群の患者さんはその半分の4.5%でした。 本試験結果は、今年9月に米国で開催された心臓血管カテーテル学会議(TCT)やポルトガルで開催された欧州IVR学会(CIRSE)でも発表されました。また、50名の患者さんを対象に、病変の部位が長い症例に限定したIMPERIAL Long Lesionサブスタディ においても、12か月の一次開存率のカプランマイヤー推定値で87.9%と良好な成績が示されました。
■製品特長
- 再狭窄が最も起こりやすい時期まで持続的に薬剤を放出
PADの治療を行う浅大腿動脈(SFA)は、再狭窄が持続して進行し、約12ヶ月後にピークを迎えます(グラフ①)。本製品は、ポリマーを搭載することで最も再狭窄が起こりやすい時期を超えて長期間薬剤の放出が維持されるように設計されています(グラフ②)。
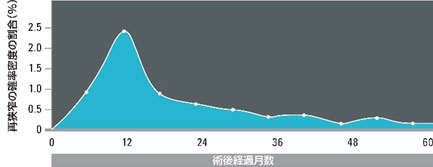
グラフ①SFA再狭窄のクリニカルヒストリー*1
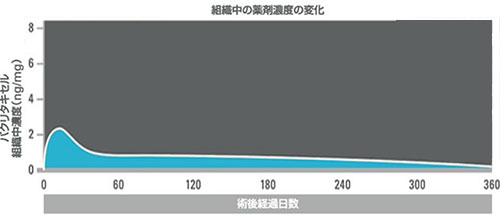
グラフ②持続的薬剤放出調整能*2
- 浅大腿動脈(SFA)の力学的ストレスにあわせた最適な強度、柔軟性およびステント断裂を防ぐ耐性(フラクチヤー耐性)
末梢動脈疾患の治療の際に本製品が留置されるSFAは、延伸、収縮といった強い力学的ストレスが発生し、再狭窄に強い影響を及ぼします。安定性と均一性を持たせるクローズドセルと、柔軟性とフラクチヤー耐性をもたらすオープンセルを組み合わせたハイブリッドステント構造など、製品設計を最適化すると共に、ポリマーの搭載による高い耐久性と、小さな力でステントを展開できる展開能を実現しています。
■末梢動脈疾患(PAD)について
末梢動脈疾患(PAD)は、動脈硬化により足や手などの血管が詰まる疾患で、糖尿病や高脂血症、高血圧といった疾患と強い因果関係があります。はじめは無症状ですが、次第に痛みや腫れが起き、生活の質(QOL)の低下をもたらします。血流が再開・維持されず、重症化すると患肢の切断に至る場合もあります。運動機能に影響を与えることから、生活習慣病をさらに悪化させ、心筋梗塞などを引き起こすリスクもあります。患者数は年々増加し、国内の潜在患者数は約300~400万人と推測されており*1、特に、腎不全など他の疾患を併発した複雑病変の方が多いといわれています。治療には運動療法や薬物療法もありますが、さらに改善が求められる場合には、バルーンカテーテルによる拡張やステント留置が行われますが、手術後にも再狭窄、再閉塞が起きるリスクが高く、再治療が必要となることが課題とされています。症状が重症化した場合には、外科的なバイパス手術が行われることもあります。
*1: (出典)Iida, O et al. Catheterization and Cardiovascular Interventions, 2011; 78: 611-617
*2:(出典)前臨床薬物動態解析、ボストン・サイエンティフィック社内資料、および、Dake MD, et al. Journal of Vascular and Interventional Radiology 2011; 22(5):603-610
非臨床および前臨床試験や結果は臨床成績を示すものではありません。270日以降の薬剤放出量は、270日時点の残存薬剤量と、それまでの放出曲線を元に算出した推定値
*3:(出典)平成24年度 次世代医療機器評価指標作成事業 重症下肢虚血分野 審査WG報告書
ボストン・サイエンティフィックについて
ボストン・サイエンティフィックは、低侵襲治療(インターベンション)に特化した医療機器メーカーとして、1979年に米国で誕生しました。現在の取扱製品は13,000種以上であり、グローバルで約29,000名の従業員、13ヵ所の製造拠点を擁し、125ヵ国近くのマーケットで確固たる地位を誇る世界最大級の医療機器メーカーとして、医療テクノロジーをリードし続けています。
世界第2位の医療機器市場である日本においては、心血管疾患領域をはじめ、不整脈・心不全疾患領域、末梢血管疾患、消化器疾患、泌尿器疾患、婦人科疾患領域、疼痛管理・パーキンソン病の治療領域で、患者さんの人生を実り多いものにすることに全力で取り組み、日本の医療に意義のあるイノベーションを起こしていきます。
https://www.bostonscientific.jp
お問い合わせ先
ボストン・サイエンティフィック ジャパン株式会社
コーポレートコミュニケーションズ&ブランディング部
村越
TEL: 03-6853-6940
E-mail: pressroom@bsci.com