RA / QA News
RA
2016 Q4 New MFDS Approval
1) PI Thruway Guidewire (2016-10-14)
2) Endo Acquire EUS-FNB Device (22ga) (2016-10-20)
3) PI ELUVIA Drug Eluting Vascular Stent System (2016-10-26)
4) PI Jetstream XC Atherectomy Catheter (2016-11-02)
5) CRM EMBLEM S-ICD Programmer(2016-10-13)
6) IC CrossBoss Catheter(2016-10-21)
7) IC SAFARI 2 Guidewire (2016-12-09)

QA
ISO 13485:2016 Training Completion
Medical Device 의 Quality Management Systems 에 대한 International Standard Guideline 인 ISO13485가 2003에서 2016으로 개정되었습니다.
이에 따라 한국에스지에스㈜로부터 외부강사를 초빙하여 ISO 13485:2016 가이드라인에 대한 교육을 12월 19일 진행하였습니다.
2003에서 2016으로 개정이 이루어지면서, Boston Scientific Global 에서도 해당 Guideline 을 기반으로 업무를 하는 모든 직원에게 필수 교육으로 assign 하려는 계획에 있으며, 한국은 해당 교육에 대한 수료 certificate 를 교육 대상자 전원이 발급 받음으로써 Global 에서의 계획보다 앞서 진행한 사례가 되었습니다.

RA
2016 Q3 RA New Product Approval
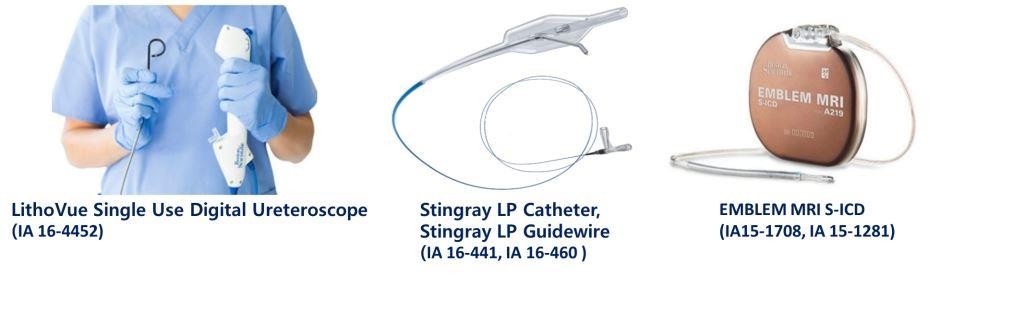
• LithoVue Single Use Digital Ureteroscope (09 Aug 2016)
• Stingray LP Catheter (12 Aug 2016)
• Stingray LP Guidewire (29 Aug 2016)
• EMBLEM S-ICD MRI (11 Aug 2016)
• EMBLEM S-ICD Electrode MRI (8 Jul 2016)
QA
2016 Everyone Makes an Impact & Patient Stories
Everyone Makes an Impact event (O/X Quiz, Puzzle game)
우리 모두는 각자의 위치에서 회사와 더 나은 환자의 삶에 기여하고 있습니다.
올해 Everyone makes an Impact 이벤트에서는 O/X퀴즈를 기본을 한 퍼즐 게임으로 회사, 동료, 그리고 Quality에 관련된 개념이나 절차를 다시금 refresh 하였습니다.
Access Patient Stories available on Intranet
Patient story 는 인트라넷 검색창에 “patient stories”키워드로 검색 가능합니다.
On 8th October 2016, Boston Scientific Korea had a big gathering ‘ONE BSK DAY’ with around 150 people including all BSK employees, Distributors and 3PL employees. The year of 2016 was especially memorable, since it is 20th company anniversary of BSK. This was a great chance to increase partnership between BSK, Distributors and 3PL which are close cooperator and friends. This event focused on serving patient care through qualified and collaborated medical solution altogether.
Taking this opportunity, BSK QA team reminded all employees of company’s value, ‘Patient care’ and ‘Quality’ with various games. There were puzzle game with several O/X quizzes about quality and procedure. The team who got the point from the quiz first got the chance to put the puzzle together. Even though it was very competitive and passionate, the final feature was a one piece of nicely harmonized picture indicating “Everyone makes an impact”. This message delivered our products’ positive effect to society from the view of patient, saying BSC is the place where change begins.
This day, every employee pledged to overcome challenges and strive to become a No.1 global medical devices company with innovative medical solution to improve patient health.

RA
2016 Q2 Korea MFDS New Product Approval
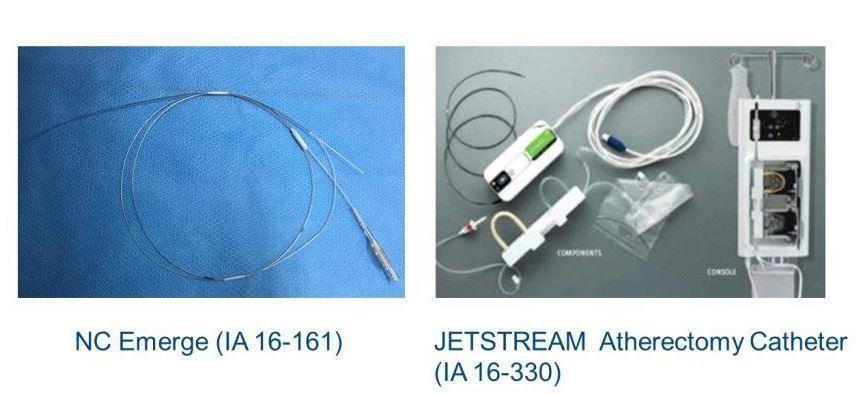
• IC: NC Emerge (Mar. 28, 2016)
• PI: JESTREAM Atherectomy Catheter (Jun. 17, 2016)
QA
품질책임자 지정
- July. 29. 2016 부터 법적의무화, 수입업 허가증 변경
- 관련 행정처분 내용
1. 품질책임자 미지정 시
- 벌금 - 의료기기법 제54조의2에 따라 300만원 이하의 벌금
- 업무정지 - 위반 회수에 따른 업무정지 행정처분
2. 품질책임자 업무행위 관련
- 경영책임자가 품질책임자 업무 방해 시 300만원 이하 벌금
- 품질책임자 업무 해태 시 300만원 이하 벌금
- 품질책임자의 의무 교육을 이행하지 않을 경우 100만원 이하 벌금
RA
2016 Q1 Korea MFDS New Product Approval
• IC: REBEL (Jan. 22, 2016)
• IC: Guidezilla (Mar. 23, 2016)

RA
2015 Q4 Korea MFDS New Product Approval and Notification
• CRM: S-ICD Programmer (Oct. 1, 2015)
• EP: Rhythmia 3D System (Ver.1.0) Capital Equipment (SW1.2) (Oct. 1, 2015)
• EP: Back Patch (Oct. 2, 2015)
• PI: Expel Ureteral Stent (Oct. 27, 2015)
• URO: Navigator HD Ureteral Access Sheath (Nov. 10, 2015)
• EP: Intella Tip MiFi Catheter (July 15, 2015)
• Endo: Rapid Exchange XL Cannula (Dec. 9, 2015)
• Endo: TWISTER PLUS (Dec. 16, 2015)
• Endo: SpyScope Access and Delivery Catheter (Dec. 15, 2015)
• Endo: SpyGlass DS Digital Controller (Dec. 12, 2015)

RA
2015 Q3 Korea MFDS New Product Approval
• CRM: EMBLEM S-ICD Electrode(July 10, 2015)
• EP: Intella Tip MiFi Catheter (July 15, 2015)
• Urology: Escape™ Nitinol Stone Retrieval Basket (Sep 03, 2015)
• Urology: Optiflex™ Nitinol Stone Retrieval Basket (Sep 10, 2015)
• EP: Maestro 4000 (Sep 17, 2015)
• EP: IntellaMap Orion Mapping Catheter (Sep 18, 2015)
•CRM: Autogen MRI, Reliance 4-Front MRI(Aug 25 2015), Autogen CRT-D MRI, Acuity X4 MRI (Sep 18, 2015)

RA
CRM 미국 본사 St. Paul 방문 (정난아 대리, Sr. RA Specialist)
지난 6월 15-18일 CRM미국 본사인 St. Paul에 방문하였습니다.
[Day 1]
아침에 회사에 출근하니 일주일 동안 제가 일 할 수 있는 책상이 마련 되어 있었습니다. 오전에 전체 CRM RA 들과 인사를 나누며 얼굴을 익히는 시간을 가졌습니다. 다들 환영해 주시고 평소에 연락하던 분들을 뵐 수 있었습니다.

[Day 2]
둘째 날 CRM의 신제품 교육이 있었습니다. 빠르게는 내년에 상용화 될 제품과 향후 몇 년 뒤 상용화 될 제품에 대해 듣고, 전반적인 CE 허가와 FDA 허가 진행 사항에 대해 들을 수 있는 유익한 시간이었습니다.

[Day 3]
Lead Facility Tour의 기회가 있었습니다. 현재 저희가 생산하고 있는 Lead의 생산방식을 알아 볼 수 있었으며 Lead의 구성에 대해 자세히 공부 할 수 있었습니다.
[Day4]
국내 MFDS 의 규정에 대해 새로 업데이트 된 내용을 전달 하였으며, 본사에서는 Dossier 준비 시 국내에 필요한 자료를 미리 준비하여 신속한 허가를 받을 수 있도록 도와 줄 것을 약속 하였습니다.


이번 St. Paul 방문을 통해 한국이 관심을 받고 있다는 사실과 MFDS 의 빠른 허가를 위한 CRM RA팀의 협력 의지를 확인 할 수 있었습니다. 특히 CRM RA팀의 노련함과 따뜻한 배려에 제가 한국 CRM RA로 함께 일 할 수 있다는 자부심을 느낄 수 있는 시간 이었습니다. CRM 제품의 Speed to Market을 위하여 파이팅!
2015 Q2 MFDS New Product Approval
- CRM: INGENIO 2.0 MRI (Accolade) (April 7, 2015)
- CRM: Watchman (April 8, 2015)
- IC: Synergy (May 11, 2015)
- PI : Expel(NG Drainage Catheter - All Purpose) (May 21, 2015)
2015 Q1 MFDS New Product Approval
- IC: LOTUS Introducer (December 31, 2014)
- IC : SAFARI™ TAVI Pre-formed Guidewire (January 21, 2015)
- CRM: Acuity Pro Guide Catheter (March 3, 2015)
- CRM: Ingevity MRI Lead (March 4, 2015)
QA
Complaint Follow-up 절차 변경 안내
그 동안 QA가 컴플레인 보고 후 본사에서 요청되는 Follow-up 질문을 SR분들께 전달해주었습니다.
그러나 이젠! Follow-up 질문이 본사에서 담당 SR에게 직접 전달됩니다. 따라서 담당 SR은 본사로부터 컴플레인에 대한 질문을 받으시면 직접 본사에 답변해 주시기 바랍니다.
컴플레인의 실물 여부 체크를 한 번 더 확인하시고 보고하여 주십시오!
또한, 컴플레인 보고 시 하기 이메일 주소를 수신에 넣어주시기 바랍니다.
- To: JapanCCC@bsci.com; KRcomplaint@bsci.com; 담당CIS메일주소(japanqacomplaintreport@bsci.com , KoreaComplaint@bsci.com 이메일 주소 사용 불가!!)